Druck-Version
Neues aus der Forschung
Ribonukleotide in der RNA-Welt
Über die Entdeckung eines neuen Synthesewegs

Eine Grundvoraussetzung für die Entstehung des Lebens vor ca. 4 Milliarden Jahren war die Existenz eines informationstragenden Biopolymers, das in der Lage sein musste, sich selbst zu replizieren. Nach heutiger Erkenntnis handelte es sich bei diesem Molekül wahrscheinlich um eine Ribonukleinsäure (RNA). Diese Annahme wird durch die Tatsache gestützt, dass bestimmte RNA-Moleküle enzymatische Aktivität entfalten und die verschiedensten chemischen Reaktionen katalysieren, unter anderem auch sich selbst replizieren und zurecht schneiden können ("splicing"). Dieser überraschende Befund führte dazu, dass eine ganze "RNA-Welt" als primordial postuliert wurde (GILBERT 1986).
Das "Rückgrat" der RNA besteht aus einer langen Kette über Phosphodiester-Bindungen abwechselnd miteinander verbundener Moleküle Phosphat sowie dem Zucker D-Ribose […-Phosphat-D-Ribose-Phosphat-D-Ribose…], wobei über eine "glykosidische Bindung" an jeweils ein Ribose-Molekül eine der vier Nukleinbasen Adenin, Uracil, Guanin und Cytosin geknüpft ist. Abb. 1 zeigt einen der vier Bausteine der RNA: das Nukleotid Uridinmonophosphat, welches über das 3'- und 5'-Ende des Ribose-Rings mit anderen Nukleotiden zur RNA kondensieren kann.
Als wesentliche Schwäche des Modells der "RNA-Welt" wurde lange Zeit die Instabilität der Ribose in freier wässriger Lösung angesehen, sowie die Schwierigkeit, die N-glykosidischen Bindungen im Nukleotid in der "korrekten" Form (zwischen dem Ring-Stickstoff der Nukleinbase und dem C1'-Atom des Zuckers) chemisch zu bewerkstelligen. Obwohl schon länger empirische Befunde vorliegen, die demonstrieren, dass aktivierte Ribonukleotide zu RNA polymerisieren können, blieb es rätselhaft, auf welchen Wegen die Ribonukleotide aus ihren Bausteinen (Ribose, Nukleinbasen und Phosphat) chemisch aufgebaut worden sein sollen.
So verläuft die Kondensation der Purine (Adenin, Guanin) mit der Ribose an der erforderlichen 1'-OH-Gruppe des Ribose-Rings nur in geringer Ausbeute und die der Pyrimidine (Cytosin und Uracil) fast gar nicht. Aufgrund dieser Schwierigkeiten wird vielfach vermutet, dass im Urmeer primär nicht RNA gebildet wurde, sondern zunächst einfachere Vorläufermoleküle der RNA, die noch ein anderes "Rückgrat" besessen haben (RAUCHFUSS 2005).
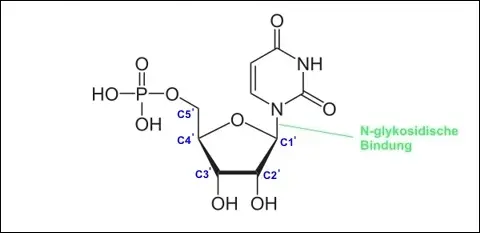
Abb. 1 Baustein der RNA: das Ribonukleotid Uridinmonophosphat. Das Zuckermolekül Ribose ist über die N-glykosidische Bindung am C1'-Atom mit der Nukleinbase Uracil verknüpft. (Die Kohlenstoffatome am Ribose-Ring sind der Nomenklatur entsprechend durchnummeriert.) Die OH-Gruppe am C5'-Atom ist mit Phosphorsäure verestert.
Ein weiteres Problem besteht darin, dass einfache Ausgangsstoffe, die bei der Synthese von Zuckern und Nukleotidbasen eine Rolle spielen, häufig unkontrolliert miteinander reagieren und dabei ein breites Spektrum an Nebenprodukten hervorbringen. So entsteht z. B. aus alkalischen Lösungen von Formaldehyd ein heterogenes Gemisch aus dutzenden verschiedener Zucker, wobei die Ribose nur in sehr geringer Ausbeute entsteht und in freier Lösung vergleichsweise rasch wieder zerfällt. Auch die aus Blausäure und Ammoniak gebildeten Intermediate reagieren miteinander zu einer Vielzahl an Produkten, wobei die gewünschten Ausgangsstoffe zur Bildung von Nukleotiden nur einen geringen Prozentsatz ausmachen (Problem der "kombinatorischen Explosion").
Vor etwa einer Woche erschien nun in der Wissenschaftszeitschrift "Nature" eine Arbeit von drei ChemikerInnen, in der die Bildung von Pyrimidin-Ribonukleotiden auf verblüffend einfache Weise beschrieben wird (POWNER et al. 2009; SZOSTAK 2009). Um die Probleme konventioneller Synthesen zu umgehen, wurden nicht etwa die Bausteine der Nukleoside (hier: der Pyrimidin-Heterozyklus und die Ribose) separat hergestellt und anschließend miteinander kondensiert, sondern durch Reaktion chemisch einfach gebauter Vorstufen beide simultan in einem Molekül aufgebaut. Der Syntheseweg führt also nicht über die freie Ribose, sondern über die Verbindung 2-Aminooxazol, so dass die schwierige Kondensation mit Pyrimidinen umgangen wird (Abb. 2).
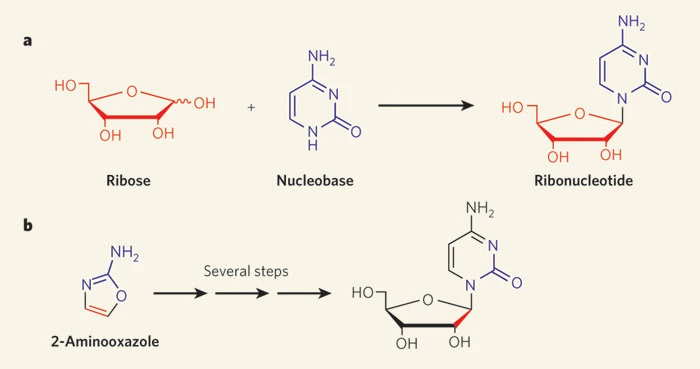
Abb. 2 Modelle zur präbiotischen Entstehung von Pyrimidin-Ribonukleotiden. (a) Nach der traditionellen Ansicht entstanden die freie Ribose sowie die Nukleinbasen separat, bevor sie miteinander zum Ribonukleosid kondensierten. (b) Dem Modell von POWNER und Kollegen zufolge ist das intermediär auftretende 2-Aminooxazol, welches sowohl zur Ribose als auch zum Pyrimidin-Ring Atome beisteuert, die gemeinsame Vorstufe beider Komponenten des Ribonukleosids. Folglich mussten diese nicht separat entstehen. Aus SZOSTAK (2009, 171). (Für eine ausführlichere Darstellung der Reaktionswege siehe POWNER 2009, 239).
Als Ausgangsstoffe dienten präbiotisch plausible Verbindungen wie Cyanamid, Cyanoacetylen, Glykolaldehyd, Glycerinaldehyd sowie anorganisches Phosphat. Dabei reagieren Glykolaldehyd und Cyanamid zunächst zum 2-Aminooxazol, welches sich mit Glycerinaldehyd und Cyanoacetylen in zwei Schritten zum Anhydroarabinonucleosid umsetzt. Dieses wird im letzten Schritt zum Pyrimidin-Ribonukleotid phosphoryliert.
Interessanterweise ist Phosphat bei dieser Reaktion nicht nur als Edukt bei der Veresterung des Nukleosids zum Nukleotid von Bedeutung. Vielmehr scheint die Anwesenheit von Phosphat selektiv gleich mehrere Teilschritte der Reaktion zu steuern, indem es z. B. als pH-Puffer und Katalysator mit nukleophilen Eigenschaften fungiert. Dadurch wird die kombinatorische Vielfalt unterdrückt, so dass kaum unerwünschte Nebenprodukte auftreten.
Diese Reaktion verdeutlicht die eminente Bedeutung von Mehrkomponenten-Systemen in der chemischen Evolution. Die bisherigen Ergebnisse deuten darauf hin, dass nicht notwendigerweise mehrstufige Reaktionen ablaufen müssen, um komplizierte Biomoleküle aufzubauen. Komplexe Gemische müssen auch nicht zwangsläufig zu einem breiten Produktspektrum mit geringen Ausbeuten führen, sofern einzelne Komponenten kooperativ verschiedene Teilschritte der Reaktion kinetisch oder thermodynamisch kontrollieren. Dass dies unter präbiotisch plausiblen Bedingungen möglich ist, belegen die empirischen Befunde auf eindrucksvolle Weise. Dadurch gewinnt auch das Modell der "RNA-Welt" ("RNA-first hypothesis") erheblich an Plausibilität.
Literatur
GILBERT, W. (1986) The RNA world. Nature 319, 618.
POWNER, M.W.; GERLAND, B. & SUTHERLAND, J.D. (2009) Synthesis of activated pyrimidine ribonucleotides in prebiotically plausible conditions. Nature 459, 239-242.
RAUCHFUSS, H. (2005) Chemische Evolution und der Ursprung des Lebens. Springer-Verlag, Berlin.
SZOSTAK, J.W. (2009) Systems chemistry on early earth. Nature 459, 171-172.
Autor: Martin Neukamm



